Formycon AG: Annahme des Zulassungsantrags für FYB202 durch die EMA!
Die Formycon AG hat sich auf die Entwicklung von Biosimilars spezialisiert. Biosimilars sind biologische Arzneimittel, die ähnliche Wirkstoffe wie bereits zugelassene biologische Medikamente haben. Sie werden entwickelt, um die gleiche therapeutische Wirkung wie das Referenzarzneimittel zu erzielen. Das Hauptziel von Formycon ist es, kosteneffiziente Alternativen zu etablierten biologischen Medikamenten anzubieten.
Experten schätzen, dass bis 2025 Biopharmazeutika mit einem Umsatz zwischen 100 und 120 Mrd. USD ihren Patentschutz verlieren werden. Der weltweite Umsatz mit Biosimilars, der derzeit rund 15 Mrd. USD beträgt, könnte nach Meinung von Branchenkennern bis 2025 auf rund 30 Mrd. USD und bis 2030 auf über 60 Mrd. USD ansteigen. Diese Potenziale will Formycon adressieren. Derzeit hat das Unternehmen mit FYB201, FYB202, FYB203, FYB206 sowie mit den bislang unveröffentlichten Projekten FYB208 und FYB209 mehrere Biosimilar-Kandidaten in der Entwicklung.
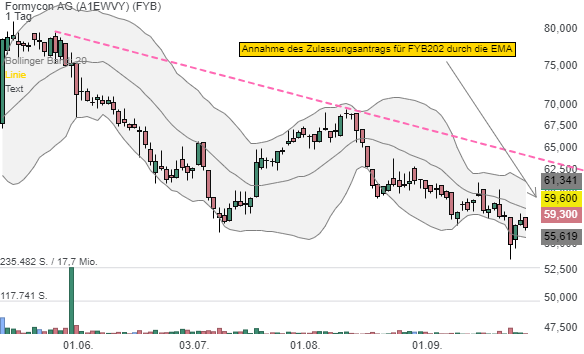
Am 29. September gab es einen neuen, positiven Trigger. So meldete der Konzern zusammen mit Fresenius Kabi, dass die EMA den Zulassungsantrag für de Ustekinumab Biosimilar-Kandidaten FYB202 angenommen hat. In der Mitteilung heißt es: "Bei FYB202 handelt es sich um einen humanen monoklonalen Antikörper, der gegen die Zytokine Interleukin-12 und Interleukin-23 gerichtet ist und zur Behandlung verschiedener schwerwiegender inflammatorischer Erkrankungen eingesetzt wird. Das Referenzarzneimittel Stelara® ist für die Behandlung von mittelschwerer bis schwerer Psoriasis (Schuppenflechte), Morbus Crohn, Colitis Ulcerosa und psoriatischer Arthritis zugelassen."
Experten schätzen, dass bis 2025 Biopharmazeutika mit einem Umsatz zwischen 100 und 120 Mrd. USD ihren Patentschutz verlieren werden. Der weltweite Umsatz mit Biosimilars, der derzeit rund 15 Mrd. USD beträgt, könnte nach Meinung von Branchenkennern bis 2025 auf rund 30 Mrd. USD und bis 2030 auf über 60 Mrd. USD ansteigen. Diese Potenziale will Formycon adressieren. Derzeit hat das Unternehmen mit FYB201, FYB202, FYB203, FYB206 sowie mit den bislang unveröffentlichten Projekten FYB208 und FYB209 mehrere Biosimilar-Kandidaten in der Entwicklung.
Am 29. September gab es einen neuen, positiven Trigger. So meldete der Konzern zusammen mit Fresenius Kabi, dass die EMA den Zulassungsantrag für de Ustekinumab Biosimilar-Kandidaten FYB202 angenommen hat. In der Mitteilung heißt es: "Bei FYB202 handelt es sich um einen humanen monoklonalen Antikörper, der gegen die Zytokine Interleukin-12 und Interleukin-23 gerichtet ist und zur Behandlung verschiedener schwerwiegender inflammatorischer Erkrankungen eingesetzt wird. Das Referenzarzneimittel Stelara® ist für die Behandlung von mittelschwerer bis schwerer Psoriasis (Schuppenflechte), Morbus Crohn, Colitis Ulcerosa und psoriatischer Arthritis zugelassen."
Kommentare
Kunden unserer Börsenmagazine können Artikel kommentieren, Rückfragen an die Autoren stellen und mit anderen Börsianern darüber diskutieren!